Venoteks®. Профилактика тромбоэмболии.
В проведенном исследовании на клиническом материале 190 пациентов, оперированных по поводу общехирургических, гинекологических и урологических заболеваний, изучена частота тромботических осложнений в зависимости от проводимой профилактики. Показана эффективность физических и фармакологических методов предупреждения венозных тромбоэмболических осложнений. Обоснована необходимость комплексной антитромботической профилактики и последовательность методов контроля за ее проведением.
Ключевые слова: тромбоз, эмболия, профилактика и алгоритмы обследования больного.
Венозные тромбоэмболические осложнения (ВТЭО) представляют собой одну из главных проблем здоровья и являются наиболее распространенным нарушением системы кровообращения [6, 16].
Эпидемиологические исследования показывают, что в общей популяции населения частота возникновения ТГВ ежегодно составляет приблизительно 160 на 100000 человек с частотой фатальной тромбоэмболии легочной артерии 60 на 100000 населения [7,25]. Однако истинная частота ТГВ остается неизвестной, поскольку в подавляющем большинстве случаев он протекает бессимптомно [9,21].
По данным различных авторов, клиническая симптоматика бывает характерной у 3-6% оперированных больных. При физикальном обследовании, правильный диагноз представляется возможным поставить в типичных случаях заболевания, а частота диагностических ошибок при этом достигает 50% [13, 19].
Ультразвуковое ангиосканирование (УЗАС) сочетающее современные цифровые технологии, позволяет не только осуществить раннюю диагностику венозных тромбозов, но и уточнить тип, характер течения и дает возможность контроля за эффективностью проводимого лечения [8, 11, 23].
Приблизительно у 25% больных с распространенным ТГВ голени, у 46% с сочетанным тромботическим поражением вен голени и бедра и у 90-98% перенесших илеофеморальный тромбоз, через 5-15 лет развивается посттробофлебетическая болезнь (ПТБ) с хронической венозной недостаточностью, вплоть до развития трофических язв [24, 28].
При данном осложнении развитие повторного ТГВ наблюдается у 21-34% пациентов, перенесших его ранее и эмболии легочной артерии у 15% из них с угрозой рецидива заболевания и в дальнейшем [14].
Самое тяжелое осложнение венозного тромбоза - ТЭЛА, удерживая 2-3 место среди летальности хирургических больных, обуславливает около 50% летальных исходов после общехиругических операций и тем самым составляет 6-25% послеоперационной летальности в хирургических стационарах [1, 2, 17, 22].
Серьезной опасностью, угрожающей больным, пережившим острый эпизод ТЭЛА, является развитие тяжелой хронической гипертензии малого круга кровообращения с прогрессирующей сердечно – легочной недостаточностью, приводящей к инвалидизации [4].
По данным различных исследований, частота ВТЭО за 20 - летний период осталась практически неизмененной, несмотря на совершенствование профилактических мер. Причиной этого считаются: увеличение среднего возраста населения, рост числа хирургических вмешательств, наличие новых, неучтенных факторов риска, неадекватная идентификация популяций риска, недостаточное использование антитромботической профилактики или отсутствие эффективности существующей [12, 15].
Все изложенное позволяет считать данную проблему в числе самых актуальных, а поиск рациональных методов антитромботической профилактики обоснованным.
Цель работы – оценка эффективности использования основных клинико-диагностических методов и их последовательности при профилактике послеоперационных венозных тромбоэмболических осложнений.
Материал и методы.
Проведен анализ результатов профилактики венозных тромбоэмболических осложнений и методов обследования за период с 2003 по 2006 г. у 190 пациентов с умеренной и высокой степенью риска развития венозных тромбоэмболических осложнений (ВТЭО) по Сh. Samama и М. Samama [27] (табл. 1). Возраст пациентов варьировался от 25 до 82 лет. Из них мужчин - 82 (43%), женщин - 108 (57%).
Хирургических больных было 103 (54,2%), гинекологических - 67 (35,3%), урологических 20 (10,5 %). Пациенты распределены на две группы - основную (135 пациентов) и контрольную (55 пациентов). Критериями отбора считали частоту тромботических осложнений в зависимости от проводимой фармакопрофилактики (табл. 2).
Пациенты основной группы были разделены на две подгруппы:
- в 1-ю подгруппу включены 60 (44,4%) пациентов, которым комплекс мер профилактики тромбоэмболических осложнений начали проводить в предоперационном периоде и продолжили на всех этапах хирургического лечения до дня выписки из стационара;
- во 2-ю подгруппу включены 75 (55,5%) пациентов, которым антикоагулянтная профилактика тромбоэмболических осложнений проводилась в отсроченном режиме (через 4-6 часов после операции в связи с угрозой геморрагических осложнений).
В контрольную группу вошли 55 пациентов, которым антикоагулянтная профилактика в течение первых суток послеоперационного периода не проводилась.
Таблица 1. Характеристика больных по профилю и степени риска развития венозных тромбоэмболических осложнений.
|
Показатель |
Число больных (n=190) |
||
|
абс. |
% |
||
|
Степени риска |
|
||
|
умеренная |
100 |
52,6 |
|
|
высокая |
90 |
47,4 |
|
|
Профиль больных |
|
||
|
хирургический |
103 |
54,2 |
|
|
гинекологический |
67 |
35,3 |
|
|
урологический |
20 |
10,5 |
|
Таблица 2. Тромботические осложнения в зависимости от проводимой фармакопрофилактики.
|
Послеоперационные тромботические осложнения |
Фармакопрофилактика гепаринами различной молекулярной массой |
Фармакопрофилактика не проводилась |
||
|
Основная группа (n=135) |
Контрольная группа(n=55)
|
|||
|
1-я подгр.(n=60) |
2-я подгр.(n=75) |
|||
|
Тромбозы в системе НПВ |
0 |
6 (8%) |
24 (43,6 %) |
|
|
ТЭЛА |
0 |
0 |
3 (5,5 %) |
|
Основным методом оценки эффективности проводимой антитромботической профилактики явилось ультразвуковое ангиосканирование (УЗАС) системы НПВ, которое выполнялось перед операцией и на 7-8 день после операции в независимости от наличия или отсутствия клинических симптомов ТГВ.
Однако при клинической картине, характерной для тромботического поражения, УЗАС осуществлялось в срочном порядке (В-режим, цветное доплеровское картирование (ЦДК), ЦДК энергии и спектральные характеристики венозного кровотока).
При обнаружении венозного тромбоза проводилась возможная оценка его давности, топическая диагностика с выявлением проксимальной части тромба, возможных признаков флотации и степени подвижности (незначительной, умеренной и выраженной).
У больных, находящихся в ОРИТ, исследование выполнялось портативным ультразвуковым сканером.
При проксимальных тромбозах мониторинг УЗАС проводился ежедневно в течении 5-7 дней, с последующим увеличением интервала в 2-3 дня на период всего срока пребывания в стационаре. При эмболоопасных формах тромботического поражения у 8 (14,6%) пациентов контрольной группы (n=55) выполнялось перфузионное сканирование легких.
Протокол гемостазиологического исследования наряду с общекоагуляционными тестами включал так же исследование активности АТ III, Протеина С, протеина S, определение фибринолитической активности крови, Хагеман - зависимого фибринолиза, а при подозрении на венозный тромбоз определение уровня Д – димера крови.
У 26 пациентов, перенесших ТГВ, исследовались наиболее тромбогенные формы наследственных тромбофилий: FV Leiden в гене фактора V, G20210А в гене протромбина, С677Т в гене 5,10 – метилентетрагидрофолат-редуктазы (МТГФР), основанные на полимеразной цепной реакции (ПЦР) рестриктазным методом и в режиме реального времени [18].
Профилактика тромбоэмболических осложнений включала физические и фармакологические средства.
В нашем исследовании уделялось большое внимание медицинским компрессионным эластическим изделиям (МЭКИ). Использовался противоэмболический компрессионный эластический трикотаж VENOTEKS® THERAPY («НИКАМЕД») у 30 пациентов и эластические бинты - также у 30 пациентов.
При средней и высокой степени риска ВТЭО применялся противоэмболический трикотаж градуированной компрессии VENOTEKS® THERAPY («НИКАМЕД») в сочетании с гепаринами различной молекулярной массы. Обследование, профилактика ВТЭО и контроль за ее результатами у пациентов проводилась с соблюдением представленных алгоритмов (рис. 1,2).
Рисунок 1. Алгоритм первичного обследования пациентов*.
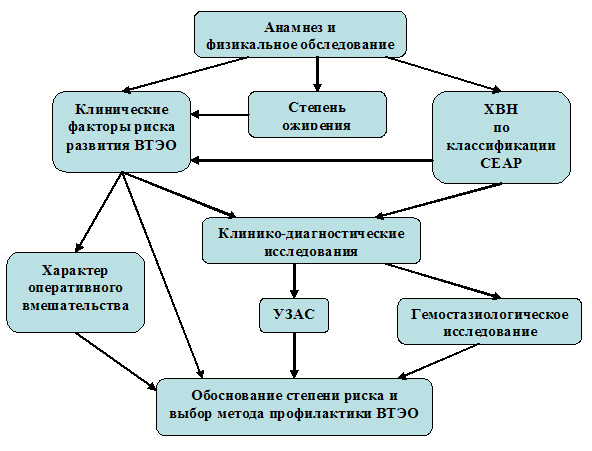
* Полное или частичное воспроизведение данного алгоритма допускается только с письменного разрешения автора.
Рисунок 2. Алгоритм последовательности основных клинико-диагностических методов контроля проводимой профилактики послеоперационных ВТЭО**
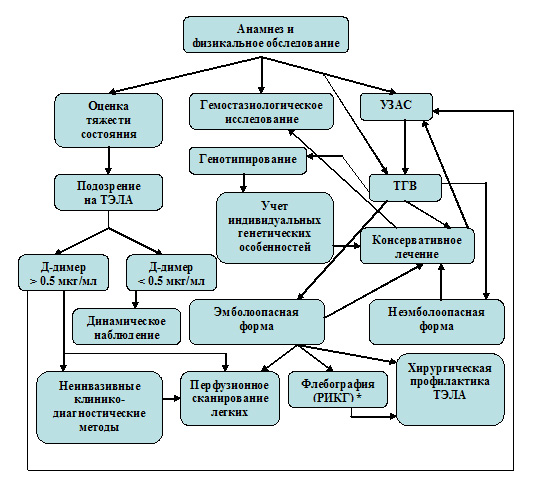
* РИКГ - ретроградная илиокавография
** Полное или частичное воспроизведение данного алгоритма допускается только с письменного разрешения автора.
Результаты и обсуждение.
Проведенное согласно представленному алгоритму (см. рис. 1) клиническое обследование больных позволило выявить степень ожирения в соответствии с индексом массы тела (ИМТ) (табл. 3).
Таблица 3. Характеристика больных по степени ожирения.
|
Группы больных |
Степени ожирения больных (n=190) |
|||||
|
I |
II |
III |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Основная (n=135) |
35 |
26 |
77 |
57 |
23 |
17 |
|
Контрольная (n=55) |
18 |
32,7 |
22 |
40 |
15 |
27,3 |
|
Всего |
53 |
27,9 |
99 |
52,1 |
38 |
20 |
Хроническая венозная недостаточность нижних конечностей как ведущий фактор риска развития ВТЭО оценивалась в соответствии с международной классификацией CEAP (табл. 4) [26].
Таблица 4. Распределение больных по группам и в соответствии со стадией хронической венозной недостаточности по классификации СEAP.
|
Группы больных |
Стадия хронической венозной недостаточности (n=190) |
||||||
|
С0,абс (%) |
С1,абс (%) |
С2,абс (%) |
С3,абс (%) |
С4,абс (%) |
С5,абс (%) |
С6,абс (%) |
|
|
Основная(n=135) |
0 |
23 (17,03%) |
68 (50,4%) |
41 (30,4%) |
3 (2,2%) |
0 |
0 |
|
Контрольная(n=55) |
0 |
8 |
26 (47,3%) |
14 (25,5%) |
4 (7,3%) |
3 (5,5%) |
0 |
|
Всего |
0 |
31 (16,3%) |
94 (49,5%) |
55 |
7 (3,7%) |
3 (1,6%) |
0 |
Уровень и частота тромботического поражения, выявленного у больных при исходном ультразвуковом исследовании в предоперационном периоде, представлена в таблице 5.
Таблица 5. Уровень и частота тромботического поражения, выявленного при УЗАС в предоперационном периоде.
|
Профиль больных |
Уровень тромбоза |
Всего (n= 190) |
||
|
вены голени |
проксимальные вены |
поверхностные вены |
||
|
хирургический(n=103) |
3 (2,9%) |
- |
2 (1,9%) |
5 (4,8%) |
|
гинекологический(n=67) |
2 (3%) |
4 (6%) |
3 (4,5%) |
9 (13,5%) |
|
урологический(n=20) |
- |
5 (25%) |
- |
5 (25%) |
Ранняя диагностика неэмбологенного тромбоза позволила провести необходимое консервативное лечение в предоперационном периоде у 10 (5,2%) больных.
Своевременная диагностика эмболопасного тромбоза у 4 (5,9%) больных гинекологического профиля позволила осуществить в предоперационном периоде эндоваскулярную профилактику с установкой интравенозного фильтра «Корона» и сочетать ее с консервативными методами.
У 3 (15%) больных урологического профиля, страдающих раком почки при УЗАС, диагностировано проксимальное тромботическое поражение с локализацией тромбоза непосредственно в нижней полой вене и в почечных венах. У 2 (10%) больных с раком предстательной железы зарегистрирован илеофеморальный венозный тромбоз.
Все вышеизложенное дает возможность считать метод УЗАС высокоинформативным, позволяющим определить дальнейшую лечебную тактику, направленную на предотвращение ВТЭО. Лабораторное исследование, проведенное на первом, предоперационном этапе, позволило выявить у 13% основной группы и у 15% контрольной группы нарушения в тромбоцитарном и плазменном звеньях системы гемостаза.
Обсуждая вопросы профилактики ВТЭО, следует отметить, что наиболее доступным методом, уменьшающим стаз в глубоких венах нижних конечностей, является эластическая компрессия [3, 5]. Однако эластические бинты являются не лучшей альтернативой противоэмболическим эластическим чулкам в связи с градиентом обратного тока крови и развитием «эффекта жгута» как следствие венозного застоя [20].
В связи с этим следует отметить, что использование у наших больных противоэмболического компрессионного трикотажа VENOTEKS® THERAPY снижает риск тромбоэмболических осложнений в послеоперационном периоде, а также предупреждает прогрессирование варикозной болезни, что является еще одним приоритетом на следующем, амбулаторном этапе лечения.
Поскольку ускорение кровотока в магистральных венах является базовым элементом системы антитромботической профилактики, в обязательном порядке нами использовались физические методы, стимулирующие антитромбогенную активность сосудистой стенки.
Характер и частота оперативных вмешательств, выполненных у 60 больных с применением противоэмболических чулок градуированной компрессии VENOTEKS® THERAPY и эластических бинтов, указаны в таблице 6.
Таблица 6. Характер и частота оперативных вмешательств с применением противоэмболических чулок VENOTEKS® THERAPY и эластических бинтов (n=60).
|
Операции |
Медицинские компрессионные эластические изделия |
|||
|
VENOTEKS® THERAPY |
Эластические бинты |
|||
|
абс. |
% |
абс. |
% |
|
|
Общехирургические: |
|
|
|
|
|
грыжесечение, пластика передней брюшной стенки |
12 |
20 |
10 |
16.6 |
|
лапароскопическая холецистэктомия |
14 |
23.3 |
15 |
25 |
|
правосторонняя гемиколэктомия |
2 |
3.3 |
1 |
1.7 |
|
восстановление целостности толстой кишки |
2 |
3.3 |
- |
- |
|
Гинекологические: |
|
|
|
|
|
чревосечение по Пфаненштилю, низкая ампутация матки |
13 |
21.7 |
12 |
20 |
|
надвлагалищная ампутация матки с придатками |
12 |
20 |
14 |
23 |
|
пластика влагалища |
5 |
8.3 |
4 |
6.7 |
Согласно представленному нами алгоритму последовательности основных клинико-диагностических методов контроля проводимой профилактики послеоперационных ВТЭО (см. рис.2), УЗАС вен нижних конечностей у этих больных выполнялось на 7-8 день послеоперационного периода. При этом тромботических поражений вен нижних конечностей не обнаружено.
В результате гемостазиологического исследования у данных больных нормокоагуляция и увеличение фибринолитической активности. Сочетание градуированной компрессии противоэмболического компрессионного трикотажа VENOTEKS® THERAPY с применением гепаринов различной молекулярной массы усилило антикоагулянтный эффект.
У 50 (26,3%) больных в связи с опасностью геморрагических осложнений при проведении оперативного вмешательства методом выбора явились физические методы, сочетающие градуированную компрессию с перемежающейся пневмокомпрессией (ППК). У 18 (36%) из них фармакопрофилактика гепаринами различной молекулярной массы проводилась в послеоперационном периоде, через 6-12 часов.
Ультразвуковое ангиосканирование проведенное нашим больным в послеоперационном периоде, позволило выявить частоту и уровень тромботического поражения в системе НПВ (табл.7).
Таблица 7. Уровень и частота тромботического поражения сосудов системы НПВ в послеоперационном периоде в основной и контрольной группах по данным УЗАС.
|
Уровень тромбоза |
Больные (n= 190) |
||
|
Основная группа (n=135) |
Контрольная группа (n=55) |
||
|
I подгруппа (n=60) |
II подгруппа (n=75) |
||
|
Вены голени |
- |
6 (4,4%) |
8 (14,6%) |
|
Проксимальные вены |
- |
- |
14 (25,5%) |
|
Поверхностные вены |
- |
- |
2 (3,6%) |
|
Всего: |
- |
6 (4,4%) |
24 (43,7%) |
При мониторинге УЗАС, выполненном среди 20 больных ОРИТ, у 3 (15%) выявлен тромбоз берцовых вен левой нижней конечности, у 2 (10%) тромбоз проксимальной локализации.
В послеоперационном периоде УЗАС проводилось в независимости от наличия или отсутствия клинических симптомов ТГВ. Необходимость ультразвукового диагностического исследования вен нижних конечностей у больных, находящихся в ОРИТ, объясняется тем, что в связи с острым нарушением жизненно важных функций организма увеличивается протромботический потенциал сосудистой стенки вследствие повреждения эндотелиоцитов [10].
Именно поэтому, у этой категории больных с возросшей опасностью развития ВТЭО и длительно пребывающих в ОРИТ в ходе нашего исследования проводился мониторинг УЗАС вен нижних конечностей, а при обнаружении тромбоза лечение базировалось на данных ультразвукового исследования.
Полученные данные позволили изменить лечебную тактику и назначить адекватные дозы антикоагулянтов.
Примером срочного УЗАС явилось его проведение в связи с клинической картиной, характерной для ТГВ, у пациента на 7-й день после операции - резекции 2/3 желудка по Гофмейстеру-Финстереру, произведенной в экстренном порядке по поводу желудочно-кишечного кровотечения.
УЗАС позволило выявить тромботическое поражение дистальных и проксимальных отделов глубоких вен обоих нижних конечностей (рис. 3 а, б).

Рис. 3а - неокклюзивный тромбоз левой поверхностной бедренной вены с распространением на общую бедренную вену вдоль передней стенки (ЦДК, продольный срез).
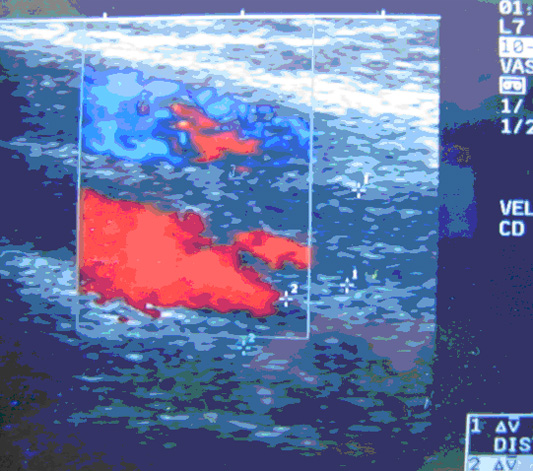
Рис. 3б - окклюзивный тромбоз левой поверхностной бедренной вены в нижней трети бедра.
При оценке степени тромбинемии как прогностического критерия развития тромбоза на различных этапах хирургического лечения по тестам растворимых фибрин-мономерных комплексов (РФМК) и Д-димер в основной группе в первые две недели после операции выявлено достоверное усиление тромбинемии в 2,1 раза (РФМК 8,8±0,1 мг%; Д-димер 0,5±0,1 мкг/мл), с дальнейшим снижением ее (РФМК 5,1±0,1 мг%; Д-димер менее 0,5 мкг/мл) в связи с повышением активности естественных антикоагулянтов – АТ III и Протеина С.
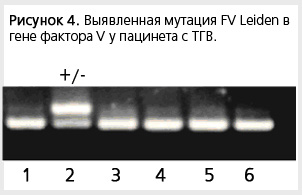
В результате проведенного молекулярно-генетического исследования выявлено, что более чем у половины – 57,6% пациентов присутствовал наследственный фактор тромбогенного риска (табл. 8, рис. 4).
Таблица 8. Характеристика мутаций, выявленных с помощью рестриктазного анализа и методом ПЦР в режиме реального времени среди пациентов, перенесших ТГВ (n = 26).
|
Исследуемые гены
|
Мутации генов, абс. (%) |
Всего |
|
|
Гетерозиготная |
Гомозиготная(+/+) |
||
|
FV Leiden |
1 (3,8 %) |
-- |
1 (3,8 %) |
|
G20210 |
-- |
-- |
-- |
|
5,10 МТГФР |
11 (42,3%) |
3 (11,5%) |
14 (53,8%) |
|
Итого: |
12 (46,1%) |
3 (11,5%) |
15 (57,6%) |
Обоснованность проведения перфузионного сканирования легких, предусмотренного данным алгоритмом, подтверждается тем, что у 3 (5,5%) больных контрольной группы выявлены признаки ТЭЛА, при том у одного больного клиническая картина ТЭЛА отсутствовала.
Таким образом, с учетом получаемой информации представленный алгоритм основных клинико-диагностических методов контроля проводимого лечения носит поливалентный характер. Он предусматривает последовательное проведение широкого спектра лечебных и диагностических мер, выбор которых обуславливается предварительно полученными результатами. Все это позволяет проводить целенаправленную коррекцию выявленных нарушений для уменьшения частоты тромботических осложнений.
Имеющиеся в доступной нам литературе различные алгоритмы по профилактике ВТЭО свидетельствуют об эволюционном развитии методов диагностики и профилактики тромботических осложнений и по сути своей направлены на улучшение результатов в данной области.
ВЫВОДЫ:
1. Комплексная профилактика ВТЭО у больных со средней и высокой степенью риска должна сочетать современные высокотехнологичные физические методы ускорения венозного кровотока (градуированная компрессия, ППК) и антикоагулянты. При эмболоопасных формах тромбоза профилактика легочной эмболии должна включать установку интравенозного фильтра.
2. Ультразвуковое ангиосканирование является высоко информативным и чаще всего применяемым методом, дающим возможность ранней диагностики тромбоза и контроля за его лечением.
3. Гемостазиологическое исследование, проводимое на различных этапах хирургического лечения, позволяет судить о степени тромбинемии и контролировать проводимую антитромботическую профилактику.
4. Поскольку перфузионное сканирование легких позволяет провести диагностику легочной эмболии, в том числе при бессимптомном ее течении, целесообразно ее проведение и при эмболоопасных тромбозах проксимальной локализации.
5. Генотипирование позволяет выявить наследственные формы тромбофилии, снижающие естественные противотромботические ресурсы, и учитывать индивидуальные генетические особенности при проведении антитромботической терапии.
Литература:
1. Баешко А.А., Шорок Т.П., Сысов А.В. Риск и профилактика тромбоза глубоких вен нижних конечностей в абдоминальной хирургии // Вестник хирургии им. И.И. Грекова. 1996; 155: 3: 34—39.
2. Добровольский С.Р., Фишкова З.П., Шереметьева Г. Ф. и др. Тромбоэмболия легочной артерии как причина летальности в торакальной хирургии // Хирургия. 1994; 9: 5-9.
3. Золотухин И.К., Богачев В.Ю. Медицинский компрессионный трикотаж: излишество или необходимость? // Ангиология и сосудистая хирургия. 1999; 4: 79-84.
4. Кириенко А.И., Мишнев О.Д., Цициашвилли М.Ш., Агафонов В.Ф. Проблемы послеоперационных венозных тромбоэмболических осложнений в хирургической практике // Ангиология и сосудистая хирургия. Т.9 №1/2003 с.61-65.
5. Покровский А.В., Сапелкин С.С. Компрессионная терапия и объединенная Европа: новые стандарты в новых реалиях // Ангиология и сосудистая хирургия. 2002; 8 №2: 53-58.
6. Савельев B.C. Послеоперационные венозные тромбоэмболичеекие осложнения: фатальная неизбежность или контролируемая опасность? // Хирургии. - 1999. - №6. - С. 60-63.
7. Савельев В.С., Гологорский В.А., Кириенко А.И. и др. Флебология. Руководство для врачей/ под ред. В.С. Савельева М. Медицина. 2001. с.175).
8. Харченко В.П., Зубарев А.Р., Котляров П.М. Ультрозвуковая Флебология. - М. ЗАО «Эники»-2005; 176с.
9. Шевченко Ю.Л., Стойко Ю.М., Лыткин М.И. Основы клинической флебологии// М.: ОАО «Издательство «Медицина », 2005. – 312 с.
10. Шевченко Ю.Л., Савельев В.С., Стойко












